Đề thi lớp 1
Lớp 2Lớp 2 - kết nối tri thức
Lớp 2 - Chân trời sáng tạo
Lớp 2 - Cánh diều
Tài liệu tham khảo
Lớp 3Lớp 3 - kết nối tri thức
Lớp 3 - Chân trời sáng tạo
Lớp 3 - Cánh diều
Tài liệu tham khảo
Lớp 4Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Lớp 5Sách giáo khoa
Sách/Vở bài tập
Đề thi
Lớp 6Lớp 6 - liên kết tri thức
Lớp 6 - Chân trời sáng tạo
Lớp 6 - Cánh diều
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 7Lớp 7 - liên kết tri thức
Lớp 7 - Chân trời sáng sủa tạo
Lớp 7 - Cánh diều
Sách/Vở bài xích tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 8Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 9Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 10Lớp 10 - liên kết tri thức
Lớp 10 - Chân trời sáng sủa tạo
Lớp 10 - Cánh diều
Sách/Vở bài tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 11Sách giáo khoa
Sách/Vở bài bác tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 12Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề & Trắc nghiệm
ITNgữ pháp tiếng Anh
Lập trình Java
Phát triển web
Lập trình C, C++, Python
Cơ sở dữ liệu

Để học xuất sắc Hóa học lớp 12, với giải bài bác tập chất hóa học 12 tốt nhất, chi tiết giúp học tập sinh dễ ợt biết giải pháp làm bài bác tập về nhà môn Hóa 12.
Bạn đang xem: Hóa học 12 bài 2: lipit giải bài tập hóa 12 trang 7
Bài 18: tính chất của kim loại. Dãy điện hóa của kim loại
Bài 19: hợp kim
Bài 20: Sự làm mòn kim loại
Bài 21: Điều chế kim loại
Bài 22: Luyện tập: đặc điểm của kim loại
Bài 23: Luyện tâp: Điều chế sắt kẽm kim loại và sự ăn mòn kim loại
Bài 24: Thực hành: Tính chất, điều chế kim loại, sự ăn mòn kim loại
Xem cục bộ tài liệu Lớp 12: tại đây
Giải bài bác Tập chất hóa học 12 – bài 21: Điều chế sắt kẽm kim loại giúp HS giải bài tập, hỗ trợ cho các em một hệ thống kiến thức và có mặt thói quen học tập tập làm việc khoa học, làm nền tảng gốc rễ cho câu hỏi phát triển năng lực nhận thức, năng lượng hành động:
Bài 1 (trang 98 SGK Hóa 12): trình bày các cách có thể :– Điều chế Ca tự Ca
CO3
– Điều chế Cu từ bỏ Cu
SO4
Viết phương trình hóa học của các phản ứng
Lời giải:
Phương pháp nhằm điều chế Ca là điện phân rét chảy muối hạt halogenua khan
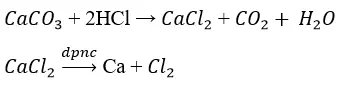
Từ Cu
SO4 pha trộn Cu có thể dùng phương thức : điện phân hỗn hợp , thủy luyện, nhiệt luyện.
– Thủy luyện : Cu
SO4 + fe → Fe
SO4 + Cu
– sức nóng luyện :
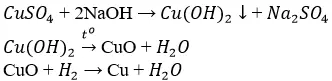
– Điện phân hỗn hợp :
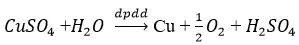
Bài 2 (trang 98 SGK Hóa 12): tự Cu(OH)2, Mg
O, Fe2O3 hãy điều chế các kim loại tương xứng bằng phương thức thích hợp. Viết phương trình hóa học của phản nghịch ứng.
Lời giải:
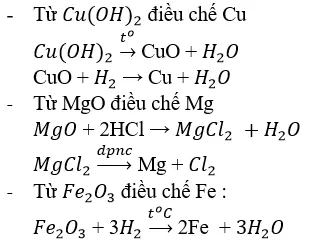
Bài 3 (trang 98 SGK Hóa 12): Một nhiều loại quặng sắt chứa 80% Fe2O3 và 10% Si
O2. Hàm lượng những nguyên tử Fe và Si trong quặng này là :
A. 56% Fe với 4,7% Si
B. 54% Fe với 3,7% Si
C. 53% Fe và 2,7% Si
D. 52% Fe cùng 4,7% Si
Lời giải:
Giả sử tất cả 100 gam quặng sắt, trọng lượng Fe2O3 là 80 gam và khối lượng Si
O2 là 10 gam
Số mol Fe2O3 là n
Fe2O3 =
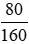
n
Fe = 2 x n
Fe2O3 = 0,5.2 = 1(mol)
→ m
Fe = 1.56 = 56(g)
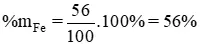
Tương từ bỏ tính cho Si , %Si = 4,7%
Đáp án là A.
Bài 4 (trang 98 SGK Hóa 12): Để khử trọn vẹn 30 gam láo lếu hợp tất cả Cu
O, Fe
O, Fe3O4, Fe2O3,Fe, Mg
O buộc phải dùng 5,6 lít khí co (đktc). Cân nặng chất rắn chiếm được sau bội nghịch ứng là :
A. 28g.
B. 26g.
C. 24g.
D. 22g.
Lời giải:
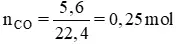
Áp dụng định chế độ bảo toàn khối lượng ta có :
30 + m
CO = m + m
CO2 → m = 30 + 0,25 x 28 – 0,25 x 44 = 26 (g)
Đáp án B.
Bài 5 (trang 98 SGK Hóa 12): Điện phân (điện cực trơ) hỗn hợp muối sunfua của một kim loại hóa trị II với loại điện cường độ 3A. Sau khi 1930 giây điện phân thấy trọng lượng catot tăng 1,92 gam.
a. Viết phương trình hóa học của bội phản ứng xảy ra tại mỗi điện rất và phương trình chất hóa học chung của việc điện phân.
Xem thêm:
b. Xác minh tên kim loại.
Lời giải:
a)PTHH
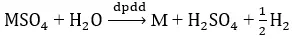
b)Theo định lao lý Faraday ta có cân nặng chất bay ra sinh hoạt điện cực là :
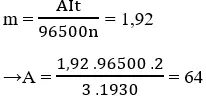
Trong đó A là nguyên tử khối
bài giải này còn có hữu ích với các bạn không?
click chuột một ngôi sao 5 cánh để tấn công giá!
gửi Đánh giá bán
Đánh giá chỉ trung bình 5 / 5. Số lượt tiến công giá: 1007
chưa xuất hiện ai tấn công giá! Hãy là người đầu tiên đánh giá bài này.
Tài liệu bên trên trang là MIỄN PHÍ, chúng ta vui lòng KHÔNG trả giá tiền dưới BẤT KỲ vẻ ngoài nào!
Điều hướng bài viết
Bài 17: địa điểm của kim loại trong bảng tuần trả và cấu tạo của kim loại
Bài 22: Luyện tập: đặc điểm của kim loại
© 2021 học tập Online cùng baigiangdienbien.edu.vn
Cung cấp bởi Word
Press / Giao diện thiết kế bởi baigiangdienbien.edu.vn