Nitơ là một nguyên tố chất hóa học chiếm khoảng tầm 78% khí quyển Trái Đất cùng là thành phần tạo cho mọi khung người sống. Tổng thể lý thuyết cơ phiên bản về khí ni tơ như: Khái niệm, tính chất, áp dụng và điều chế sẽ được giải đáp chi tiết nhất trong nội dung bài viết dưới đây.
Bạn đang xem: Nito trong thiên nhiên là hỗn hợp

Kí hiệu: N2 cùng thường tồn tại sinh hoạt dạng khí với links 3.
Cấu hình electron nguyên tử: 1s2 2s2 2p3. Như vậy, kết cấu electron của N2 tất cả 2 lớp, phần ngoài cùng vỏ bao gồm 5 electron hoạt động. Vày vậy, một số loại khí này được coi là một phi kim vận động mạnh.
Công thức cấu tạo: N ≡ N
Trạng thái tự nhiên và thoải mái của nitơ
Sau khi đang biết khí ni tơ là hóa học gì, cùng tò mò các dạng mãi mãi của nó bao bọc ta. Vào tự nhiên, ni tơ tồn tại bên dưới dạng thoải mái và hợp chất.
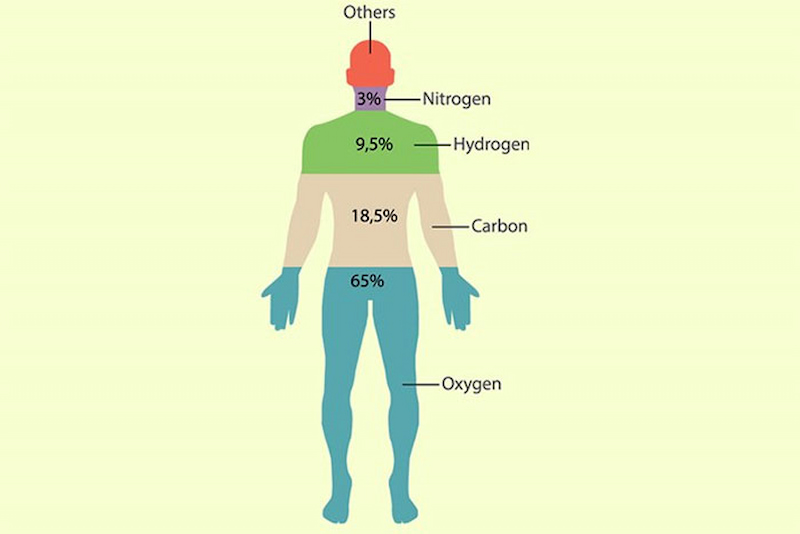
Nito thiên nhiên chiếm phần 78.16% thể tích ko khí, là các thành phần hỗn hợp của 2 đồng vị: 14/7N(99.63%) và 15/7N(0.37%)
Nito bên dưới dạng thích hợp chất có không ít trong natri nitrat Na
NO3 với tên thường gọi diêm tiêu natri.
Nito xuất hiện trong tất cả các khung hình sống, chủ yếu dưới dạng những amino acid (protein) và cũng đều có trong các acid nucleic (RNA cùng DNA). Theo nghiên cứu, khung hình con tín đồ chứa khoảng tầm 3% nitơ theo trọng lượng. Đây là nguyên tố phổ biến thứ tư trong khung hình đứng sau oxy, cacbon và hydro.
Tính chất vật lý của khí nitơ
Sau đây là những đặc thù vật lý cơ phiên bản của nitơ mà bạn cần nhớ:

Nitơ là một trong chất khí không màu, ko mùi, ko vị và có trọng lượng nhẹ hơn không khí N2=28, có cách gọi khác là đạm khí.
Ít rã trong nước (ở đk thường, 1 lít nước hài hòa được 0.015 lít khí nitơ)
Nhiệt độ hóa lỏng ngơi nghỉ – 196 độ
C và ánh sáng hóa rắn cũng khá thấp. Nitơ lỏng là một dạng hợp chất giống nước tuy vậy chỉ tất cả 80.8% nitơ nghỉ ngơi điểm sôi, hằng số năng lượng điện môi là 1.4.
Không duy trì sự cháy và sự sống.
Tính chất hóa học của nitơ
Vậy đâu là những đặc điểm hóa học của nitơ?

Ni tơ là 1 chất có link 3 khôn cùng bền, thậm chí còn ở 3000*C nó vẫn không bị phân hủy rõ rệt thành những nguyên tử.
Ở ánh nắng mặt trời thường, Nitơ trơ về khía cạnh hóa học cơ mà trở nên hoạt động hơn và tác dụng được với tương đối nhiều chất khi ở ánh sáng cao.
Trong những hợp chất cộng hóa trị của nitơ với hồ hết nguyên tố tất cả độ âm điện nhỏ hơn (như hidro, kim loại...), nitơ tất cả oxi hóa -3.
Trong các hợp chất cộng hóa trị của nitơ với gần như nguyên tố gồm độ âm điện lớn hơn (oxi, clo, flo), nitơ tất cả số lão hóa dương, tự +1 cho +5.
Như vậy, khi thâm nhập phản ứng thoái hóa - khử, ni tơ rất có thể giảm hoặc tăng số oxi hóa. Vì tại sao này, nitơ vừa có tính oxi hóa, vừa gồm tính khử. Trong đó, tính oxi hóa là đặc điểm chủ yếu ớt của N2.
Nitơ bao gồm tính oxi hóa
Với hầu hết các nhân tố kim loại, nitơ sẽ công dụng ở nhiệt độ cao, biểu hiện tính oxi hóa khi sút số lão hóa từ 0 xuống -3 với các xúc tác là khí hidro, nhiệt độ, áp suất. Không tính trường hợp tác dụng với Li ( có thể công dụng ở đk thường).
Tác dụng cùng với kim loạiỞ ánh sáng cao, nitơ diễn đạt tính thoái hóa khi chức năng với một trong những kim loại chuyển động mạnh như Ca, Mg, Al… và tạo thành thành nitrua kim loại.
Ví dụ:
3Mg + N2 → Mg3N2 (nhiệt độ)
0 -3
Tác dụng cùng với hidroỞ nhiệt độ cao, áp suất cao và xuất hiện chất xúc tác, ni tơ bao gồm thể chức năng trực tiếp với Hidro tạo thành amoniac theo phương trình:
N2 + 3H2 → ← 2NH3 (nhiệt độ, P, hóa học xúc tác)
0 -3
Trong bội nghịch ứng này, nitơ mô tả tính oxi hóa khi số oxi hóa bớt từ 0 xuống -3.
Nitơ có tính khử
Ở nhiệt độ độ khoảng tầm 3000 độ C (hoặc xúc tiếp với tia lửa điện), nitơ sẽ biểu lộ tính khử khi kết hợp trực tiếp cùng với oxi và tạo thành khí nitơ monooxit NO theo phương trình:
N2 + O2 → ←2NO (nhiệt độ)
0 +2
Như vậy, nito biểu thị tính khử khi số thoái hóa tăng tự 0 mang đến +2. Hóa học này có khả năng sẽ bị hóa nâu đỏ trong không khí sản xuất thành NO2.
Nitơ oxit là 1 nhóm các hợp chất - thành phầm được tạo ra bởi hai nguyên tố N cùng O.Chúng sẽ có những tính chất không giống nhau và tính năng khác nhau tùy trực thuộc vào cấu trúc. Chẳng hạn: N2O là một trong những chất khí tạo cười, vô ích cho óc bộ, NO2 lại là yếu tắc gây ô nhiễm và độc hại môi trường, áp dụng trong y tế hoặc được dùng làm thành phần trong phân bón hóa học.
Điều chế nitơ như thế nào?
Có khôn xiết nhiều phương pháp để điều chế N2 nhưng mà dưới đây là một số cách thức phổ phát triển thành nhất.

Điều chế nitơ trong phòng thí nghiệm
Trong phòng thí nghiệm, fan ta điều chế nitơ tinh khiết bằng cách đun nóng dịu dung dịch bão hòa muối bột amoni nitrit (hoặc sửa chữa thay thế bằng amoni clorua với natri nitrit).
Phương trình:
NH4NO2 → N2 (↑) + 2H2O (nhiệt độ)
NH4Cl + Na
NO2 → N2 (↑) + Na
Cl + 2H2O (nhiệt độ)
Bên cạnh đó, để điều chế nitơ trong chống thí nghiệm, bạn ta cũng rất có thể đun lạnh amoni dicromat (NH4)2Cr2O7 hoặc phân hủy nhiệt Natri Azide hoặc Bari Azide.
Sản xuất nitơ trong công nghiệp
Trong công nghiệp, nitơ được cấp dưỡng bằng cách thức chưng đựng phân đoạn bầu không khí lỏng dưới áp suất cao và nhiệt độ quá thấp sau khi đào thải CO2 với hơi nước. Khi ánh nắng mặt trời không khí lỏng được nâng mang lại -196 độ C, nitơ sôi với được mang ra.

Bên cạnh đó, nitơ vào công nghiệp cũng khá được điều chế bằng phương thức cơ học tập lọc màng, áp dụng áp suất (PSA).
Đây là hai trong số những cách điều chế N2 chế tạo ra ra được không ít sản phẩm và tốn ít giá cả nhất tất cả thể. Nitơ được vận tải trong bình thép với áp suất nén 150atm.
Ứng dụng của nitơ vào đời sống, công nghiệp
Khí nitơ có vai trò ra làm sao trong đời sống của bọn chúng ta? Khí ni tơ có ích hay tất cả hại, sử dụng chúng ra sao? Cùng tò mò ứng dụng của nitơ trong đời sống, công nghiệp bên dưới 3 dạng: Khí nitơ, hợp hóa học nitơ và khí nito lỏng.

Ứng dụng hợp hóa học nitơ
Phân tử nitơ trong khí quyển tương đối trơ, tuy vậy trong từ nhiên, nó được đưa hóa rất chậm trễ thành các hợp chất hữu dụng về phương diện sinh học với công nghiệp. Phối hợp hay cố định nitơ là quánh trưng đặc biệt quan trọng trong công nghiệp hóa chất hiện đại. Nitơ được chuyển hóa thành amonia - chất này rất có thể sử dụng trực tiếp dưới dạng phân bón hoặc thay đổi nguyên liệu cho các hóa chất quan trọng như dung dịch nổ, nhiên liệu mang đến tên lửa.
Ứng dụng khí nitơ lỏng
Nitơ lỏng là gì? Nitơ lỏng là nitơ sinh sống trạng thái lỏng, ánh sáng của nó quá thấp (khoảng -196 độ C), nó rất có thể phá hủy phần đông thứ liên quan đến sự sống. Nó là 1 trong trong những loại nội lực nghiệp cùng có vận dụng rộng rãi.

Nitơ lỏng được phân phối theo bài bản công nghiệp được nghe biết như một tác nhân có tác dụng lạnh hoàn toàn có thể làm cứng ngay lập tức những mô sống khi tiếp xúc. Nó gồm vai trò như một hóa học cô đặc cùng là nguồn chuyển động của nitơ dạng khí không đề xuất nén. Kế bên ra, nó bao gồm thể gia hạn nhiệt độ một phương pháp đáng tởm ngạc. Với khả năng bay tương đối ở 77 K (-196°C xuất xắc -320°F), ni tơ lỏng rất là hữu ích trong nhiều ứng dụng khác nhau, chẳng hạn như:
Làm rét mướt thực phẩm trong quy trình vận chuyển.
Bảo quản các chủng loại và chế tác sinh học sinh học tập (bộ phận thân thể hay các tế bào tinh trùng và trứng…).
Ứng dụng trong không ít nghiên cứu các tác nhân làm cho lạnh.
Minh họa trong giáo dục.
Loại bỏ những tổn thương domain authority ác tính hay tiềm năng gây ung thư (mụn cóc, vệt chai sần bên trên da…)
Nguồn làm mát nhằm tăng tốc CPU, GPU, hay các dạng phần cứng khác.
Ứng dụng của khí nitơ
Nitơ dạng khí được thêm vào nhanh chóng bằng cách cho nitơ lỏng nóng lên và cất cánh hơi. Chất khí này mang những ứng dụng, phổ biến như:
Bảo quản độ tươi của thực phẩm đóng gói (bằng bài toán làm chậm quá trình oxi hóa).
Đảm bảo an toàn cho chất nổ lỏng.
Sản xuất các linh kiện điện tử (như transistor, diode, với mạch tích hợp IC).
Sản xuất thép không gỉ, bơm lốp ô tô và sản phẩm công nghệ bay.
Được áp dụng như là một chất thay thế được yêu chuộng cho dioxide cacbon để tạo nên áp lực cho những thùng chứa một trong những loại bia. Nó ít tạo nên bọt hơn, điều này khiến cho bia nhuyễn với nặng hơn.
Bài tập về nitơ SGK chất hóa học 11 kèm lời giải chi tiết
Cùng vận dụng những lý thuyết cụ thể về nitơ ở các phần trên nhằm thực hành một trong những bài tập cơ bản trong SGK hóa học 11 dưới đây.

Giải bài xích 1 trang 31 SGK Hóa 11
Trình bày kết cấu của phân tử N2? bởi vì sao ở đk thường nitơ là 1 trong những chất trơ? Ở đk nào nitơ trở nên hoạt động hơn?
Lời giải:
Cấu hình e của nitơ: 1s22s22p3
CTCT của phân tử nitơ: N ≡ N
Giữa hai nguyên tử trong phân tử N2 có mặt một links ba bền vững. Mỗi nguyên tử nitơ vào phân tử N2 tất cả 8e lớp ngoài cùng, trong số đó có tía cặp e dùng chung và 1 cặp e dùng riêng sẽ ghép đôi.
Ở điều kiện thường, nitơ cực kỳ trơ bởi vì có links ba bền bỉ giữa hai nguyên tử. Ở 3000 độ C, links cũng không bị phân huỷ rõ rệt thành nguyên tử.
Ở nhiệt độ cao, nitơ trở nên vận động vì phân tử N2 phân huỷ thành nguyên tử nitơ gồm 5e lớp bên ngoài cùng và tất cả độ âm điện kha khá lớn (3.04) phải trở phải hoạt động.
Giải bài xích 2 SGK Hóa 11 trang 31
Nitơ không bảo trì sự hô hấp, nitơ bao gồm phải tà khí không?
Lời giải: Nitơ không phải là khí độc tuy vậy không bảo trì sự sống cùng sự cháy.
Giải bài xích 3 SGK trang 31 Hóa 11
a. Tìm các cặp phương pháp đúng của liti nitrua và nhôm nitrua:
A. Li
N3 cùng Al3N
B. Li3N cùng Al
N
C. Li2N3 và Al2N3
D. Li3N2 và Al3N2
b. Viết phương trình hoá học tập của làm phản ứng chế tạo thành liti nitrua và nhôm nitrua khi cho liti và nhôm tác dụng trực tiếp với nitơ. Trong số phản ứng này nitơ là chất oxi hoá hay hóa học khử?
Lời giải:
a. Đáp án B
Khi links với kim loại, nitơ dễ dìm thêm 3e (Nitơ bao gồm 5e phần ngoài cùng nên có số oxi hoá -3 còn Li dễ nhường 1e và Al dễ nhường 3e cần lần lượt gồm số oxi hoá là +1 với +3).
b.
6Li + N2 → 2Li3N
0 0 +1 -3
2Al + N2 → 2Al
N
0 0 +3 -3
Ta thấy trong những phản ứng trên nitơ là chất oxi hoá vì:
N2 + 6e → 2N
0 -3
Giải bài 4 trang 31 Hóa 11 SGK
Nguyên tố nitơ bao gồm số oxi hoá là bao nhiêu trong các hợp chất sau: NO, NO2, NH3, NH4Cl, N2O, N2O3, N2O5, Mg3N2?
Lời giải:
Trong những hợp chất trên, số oxi hoá của nitơ theo lần lượt là: +2, +4, -3, -3, +1, +3, +5, -3.
Giải bài 5 Hóa 11 SGK trang 31
Cần bao nhiêu lít khí nitơ với khí hiđro để điều chế được 67.2 lit khí amoniac? biết rằng thể tích của các khí đề được đo sinh sống cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%?
Lời giải:
Ta thấy tỉ lệ về thể tích thuộc là tỉ lệ về số mol:
N2 + 3H2 → 2NH3 (P, sức nóng độ, xúc tác)
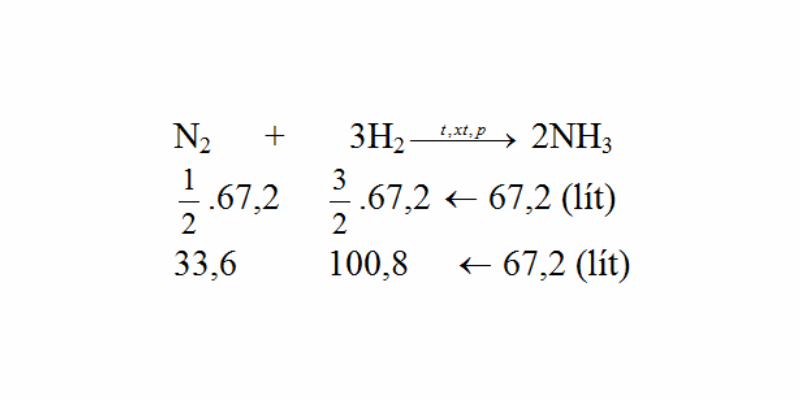
Tỉ lệ số mol cũng đó là tỉ lệ thể tích
Theo phương trình:
V(N2) = 50% x V(NH3) = một nửa x 67.2 = 33.6lit
V(H2) = 3/2 V(NH3) = 3/2 x 67.2 x 100.8lit
Do công suất của bội nghịch ứng là 25%, thể tích của nitơ và hidro đề xuất lấy là:
V(N2) = 33.6 x 100/25 = 134.4 lit
V(H2) = 100.8 x 100/25 = 403.2 lit
Như vậy, nội dung bài viết trên đã khiến cho bạn đọc có thêm những kiến thức và kỹ năng cơ phiên bản về nitơ, bao gồm: Nitơ là gì, đặc thù vật lý, hóa học, áp dụng và pha trộn nitơ. Monkey hi vọng những tin tức này sẽ bổ ích cho quá trình học tập của bạn. Đừng quên truy cập website của Monkey mỗi ngày để nhận thêm nhiều bài học thú vị khác về môn Toán, Lý, Hóa những cấp học!
Câu hỏi:Nitơ trong vạn vật thiên nhiên là lếu láo hợp bao gồm hai đồng vị là 147N (99,63%) cùng A7N (0,37%). Vào HNO3 14N chiếm phần 22,1387% khối lượng. Nguyên tử khối của đồng vị trang bị hai của Nitơ là:
MN = 14 x 0,9963 + A x 0,0037 = 13,9482 + 0,0037A.
Xem thêm: Gạo Lứt Dẻo Điện Biên, 1Kg, Gạo Lứt Đỏ Điện Biên Gói 1Kg
(\% ^14N = frac14.0,99631 + 13,9482 + 0,0037A + 16.3 = 22,1387\% )→ A = 15→ lựa chọn B.


Toán 10
Toán 10 kết nối Tri Thức
Toán 10 Chân Trời sáng sủa Tạo
Toán 10 Cánh Diều
Giải bài xích tập Toán 10 kết nối Tri Thức
Giải bài bác tập Toán 10 CTST
Giải bài bác tập Toán 10 Cánh Diều
Trắc nghiệm Toán 10
Ngữ văn 10
Ngữ Văn 10 kết nối Tri Thức
Ngữ Văn 10 Chân Trời sáng Tạo
Ngữ Văn 10 Cánh Diều
Soạn Văn 10 liên kết Tri Thức
Soạn Văn 10 Chân Trời sáng sủa tạo
Soạn Văn 10 Cánh Diều
Văn chủng loại 10
Tiếng Anh 10
Giải tiếng Anh 10 liên kết Tri Thức
Giải giờ Anh 10 CTST
Giải giờ đồng hồ Anh 10 Cánh Diều
Trắc nghiệm tiếng Anh 10 KNTT
Trắc nghiệm giờ Anh 10 CTST
Trắc nghiệm giờ Anh 10 CD
Giải Sách bài tập tiếng Anh 10
Vật lý 10
Vật lý 10 kết nối Tri Thức
Vật lý 10 Chân Trời sáng Tạo
Vật lý 10 Cánh Diều
Giải bài tập Lý 10 kết nối Tri Thức
Giải bài xích tập Lý 10 CTST
Giải bài bác tập Lý 10 Cánh Diều
Trắc nghiệm đồ vật Lý 10
Hoá học tập 10
Hóa học 10 kết nối Tri Thức
Hóa học tập 10 Chân Trời sáng Tạo
Hóa học tập 10 Cánh Diều
Giải bài tập Hóa 10 liên kết Tri Thức
Giải bài xích tập Hóa 10 CTST
Giải bài tập Hóa 10 Cánh Diều
Trắc nghiệm Hóa 10
Sinh học 10
Sinh học tập 10 liên kết Tri Thức
Sinh học tập 10 Chân Trời sáng Tạo
Sinh học 10 Cánh Diều
Giải bài tập Sinh 10 kết nối Tri Thức
Giải bài tập Sinh 10 CTST
Giải bài tập Sinh 10 Cánh Diều
Trắc nghiệm Sinh học tập 10
Lịch sử 10
Lịch Sử 10 liên kết Tri Thức
Lịch Sử 10 Chân Trời sáng Tạo
Lịch Sử 10 Cánh Diều
Giải bài bác tập lịch sử 10 KNTT
Giải bài xích tập lịch sử vẻ vang 10 CTST
Giải bài xích tập lịch sử vẻ vang 10 Cánh Diều
Trắc nghiệm lịch sử hào hùng 10
Địa lý 10
Địa Lý 10 kết nối Tri Thức
Địa Lý 10 Chân Trời sáng Tạo
Địa Lý 10 Cánh Diều
Giải bài tập Địa Lý 10 KNTT
Giải bài bác tập Địa Lý 10 CTST
Giải bài bác tập Địa Lý 10 Cánh Diều
Trắc nghiệm Địa lý 10
GDKT & PL 10
GDKT & PL 10 liên kết Tri Thức
GDKT và PL 10 Chân Trời sáng sủa Tạo
GDKT & PL 10 Cánh Diều
Giải bài tập GDKT và PL 10 KNTT
Giải bài tập GDKT & PL 10 CTST
Giải bài xích tập GDKT & PL 10 CD
Trắc nghiệm GDKT và PL 10
Công nghệ 10
Công nghệ 10 kết nối Tri Thức
Công nghệ 10 Chân Trời sáng Tạo
Công nghệ 10 Cánh Diều
Giải bài bác tập công nghệ 10 KNTT
Giải bài bác tập công nghệ 10 CTST
Giải bài tập technology 10 CD
Trắc nghiệm công nghệ 10
Tin học tập 10
Tin học 10 liên kết Tri Thức
Tin học tập 10 Chân Trời sáng Tạo
Tin học 10 Cánh Diều
Giải bài tập Tin học tập 10 KNTT
Giải bài bác tập Tin học 10 CTST
Giải bài tập Tin học tập 10 Cánh Diều
Trắc nghiệm Tin học tập 10
Xem nhiều nhất tuần
Đề thi thân HK1 lớp 10
Đề thi thân HK2 lớp 10
Đề thi HK1 lớp 10
Đề thi HK2 lớp 10
Video bồi dưỡng HSG môn Toán
Toán 10 Kết nối trí thức Bài 1: Mệnh đề
Toán 10 Chân trời sáng chế Bài 2: Tập hợp
Toán 10 Cánh Diều bài xích tập cuối chương 1
Soạn bài xích Chữ fan tử tội phạm - Nguyễn Tuân - Ngữ văn 10 KNTT
Soạn bài xích Thần Trụ Trời - Ngữ văn 10 CTST
Soạn bài bác Ra-ma buộc tội - Ngữ văn 10 Tập 1 Cánh Diều
Văn chủng loại về Chữ người tử tù
Văn mẫu mã về cảm hứng mùa thu (Thu hứng)
Văn chủng loại về Bình Ngô đại cáo
Văn mẫu mã về Tây Tiến

Kết nối với chúng tôi
TẢI ỨNG DỤNG HỌC247


Thứ 2 - thứ 7: trường đoản cú 08h30 - 21h00
baigiangdienbien.edu.vn.vnThỏa thuận sử dụng
Đơn vị chủ quản: công ty Cổ Phần giáo dục và đào tạo HỌC 247
Chịu trách nhiệm nội dung: Nguyễn Công Hà - Giám đốc doanh nghiệp CP giáo dục và đào tạo Học 247